作者,Evil Genius
最近一直黑白颠倒的过,晚上打游戏,打麻将,打台球,白天睡觉,以前上大学的时候也这么干过,感觉还好,现在30多了,这么干白天感觉特别累,根本起不来,4个人都差不多,看来青春早就离开了。
今天我们分享文献,中南大学的文章,现在真的是太卷了,不过我还是喜欢中南大学的自动化专业,虽然我的专业也是工科,食品科学与工程,但是离纯理工科专业,例如自动化,车辆工程等差距太远,现在后悔也来不及了。

知识积累
大家还记得文章思路分享–肿瘤细胞异质性过高怎么办?里面讲到的吧,现在单细胞空间的分析研究不能简单的说一下是癌种样本就可以了,而是要根据病理和基因组信息进行详细分子分型。这篇文章专门采用了其中的一个亚型,肺腺癌(非小细胞肺癌中最常见的亚型)。
肿瘤异质性——涵盖基因组、细胞和代谢等多个维度——既是疾病进展的内在驱动力,也是治疗响应差异的根本原因。
乳酸作为有氧糖酵解(瓦博格效应)的传统代谢终产物,现已被重新定义为癌症中的核心信号分子与免疫代谢调节剂。包括肺腺癌在内的多种实体肿瘤普遍存在乳酸水平升高现象,其形成的酸性微环境具有显著免疫抑制特性。
高浓度胞外乳酸不仅抑制T细胞增殖与功能,诱导巨噬细胞向促肿瘤M2型极化,更能通过HIF-1α依赖途径激活内皮细胞促进血管生成。此外,乳酸还可作为氧化型肿瘤细胞及基质成分的替代能源,进一步增强肿瘤代谢的可塑性。
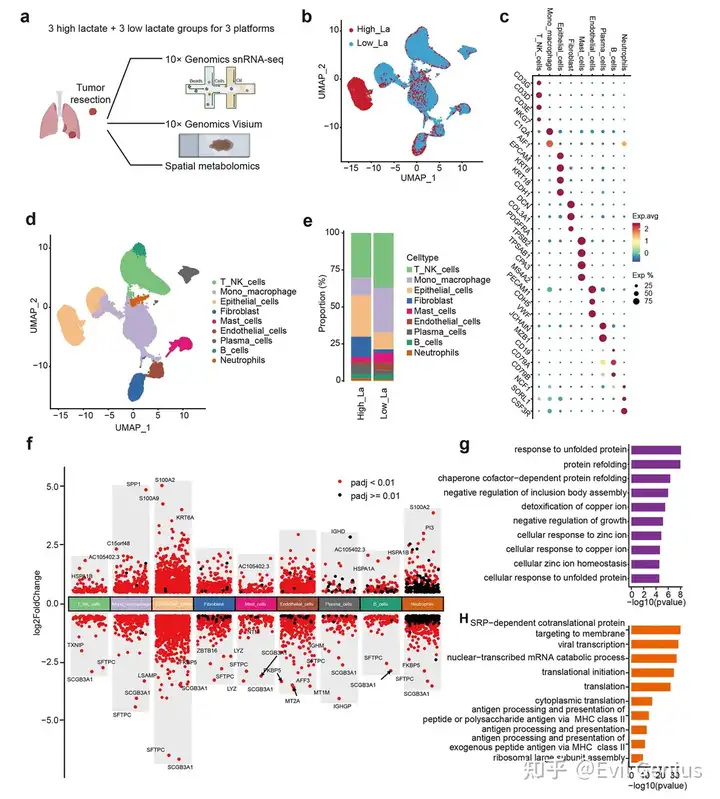
结果1、单细胞转录组分析揭示肺腺癌中乳酸水平相关的独特细胞与分子特征
对高乳酸水平与低乳酸水平患者的肿瘤样本(每组n=3)进行了单细胞转录组测序、空间转录组学及空间代谢组学的整合分析。
乳酸可能发挥细胞类型特异性的调节作用:在T/NK细胞中促进免疫抑制和应激反应,在内皮细胞中驱动血管生成性重塑,并在B细胞中选择性调节体液免疫功能。
细胞间通讯分析显示,与低乳酸组相比,高乳酸组上皮细胞之间以及上皮细胞与内皮细胞之间的相互作用数量显著增加。这种增强表明,升高的乳酸水平可能促进上皮细胞网络化和血管交互作用,已知这些过程会促进肿瘤生长、新生血管形成和微环境重塑。
整体来看,在高乳酸肿瘤中,包括VEGF、ApoE、WNT、PARs、PTN和TGF-β在内的多个信号通路表现出更高的细胞间通讯活性。这些通路已知参与细胞增殖、免疫调节和血管发育,强调了乳酸在强化肿瘤微环境内促肿瘤信号网络中的作用。
总而言之,研究结果表明,升高的乳酸水平重塑了肺腺癌的细胞间通讯格局。这种乳酸驱动的细胞相互作用重组,可能有助于形成免疫抑制和促血管生成的肿瘤微环境,从而促进疾病进展,并可能限制免疫治疗的疗效。
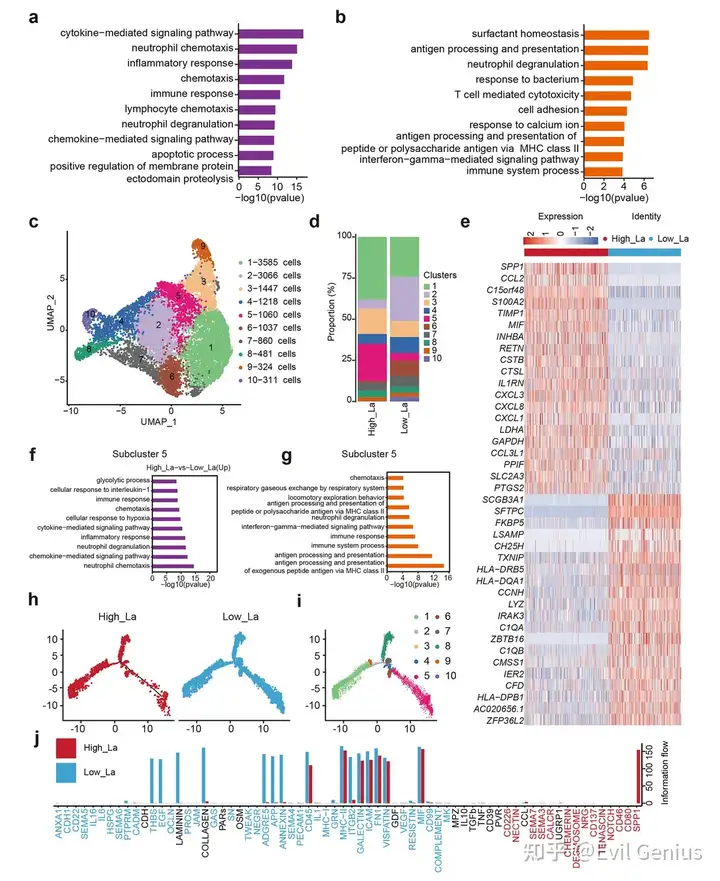
结果2、富乳酸肺腺癌微环境中的单核/巨噬细胞
单核细胞与巨噬细胞是肿瘤微环境中免疫稳态与炎症反应的核心调控者。在肺腺癌中,它们发挥着双重作用——既参与抗肿瘤免疫,也可通过免疫抑制极化、促进血管生成及细胞外基质重塑等方式驱动肿瘤进展。越来越多的证据表明,代谢信号(尤其是乳酸积累)能深刻重塑肿瘤相关巨噬细胞(TAMs)的表型与功能。
单核/巨噬细胞亚群分析鉴定出具有促肿瘤特征的代谢适应性亚型(亚群5),其分化轨迹受乳酸梯度调控。细胞通讯网络分析进一步表明,乳酸通过激活SPP1、VEGF等信号通路,增强上皮-内皮相互作用及纤维炎症信号传导,从而协同促进免疫抑制微环境形成、血管新生及细胞外基质重构。
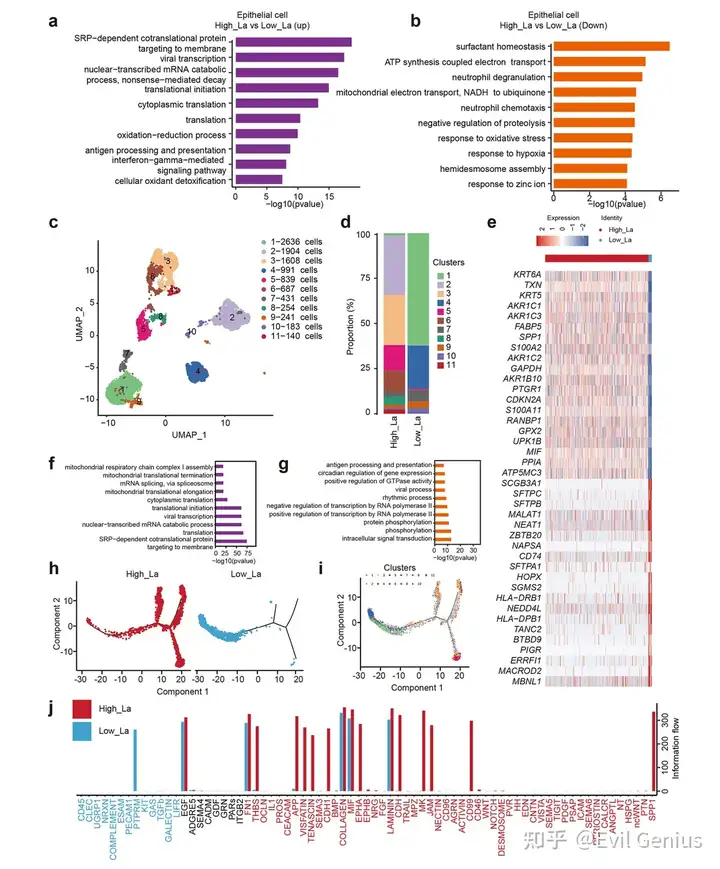
结果3、乳酸积累诱导肺腺癌上皮细胞可塑性研究
上皮细胞作为肺腺癌结构与功能的基础,其动态表型转变在肿瘤发生、进展及治疗抵抗中发挥关键作用。
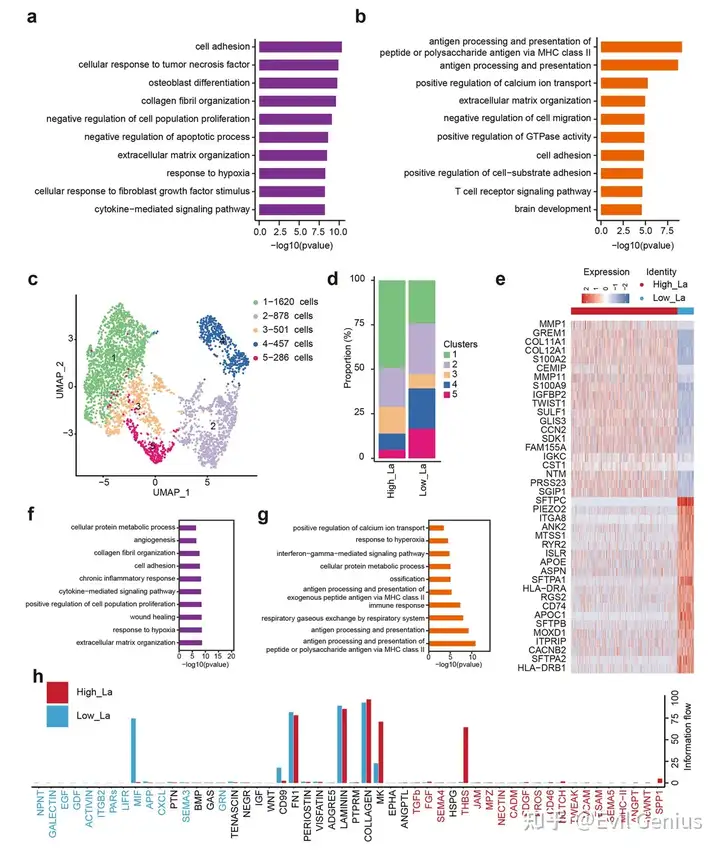
结果4、高乳酸肿瘤微环境中成纤维细胞的表型转变
乳酸等代谢副产物可重编程成纤维细胞表型,进而影响肿瘤进展、治疗抵抗及免疫排斥。
肺腺癌微环境中升高的乳酸水平诱导成纤维细胞功能从免疫调节与结构维持向促肿瘤、促血管生成及基质重塑表型转变,从而可能促进肿瘤进展并增强对免疫监视的抵抗。
结果5、乳酸驱动肺腺癌内皮细胞转录重编程研究
肿瘤微环境中的乳酸积累可驱动内皮细胞向促血管生成与组织重塑状态重编程,进而促进肺腺癌进展与免疫逃逸。
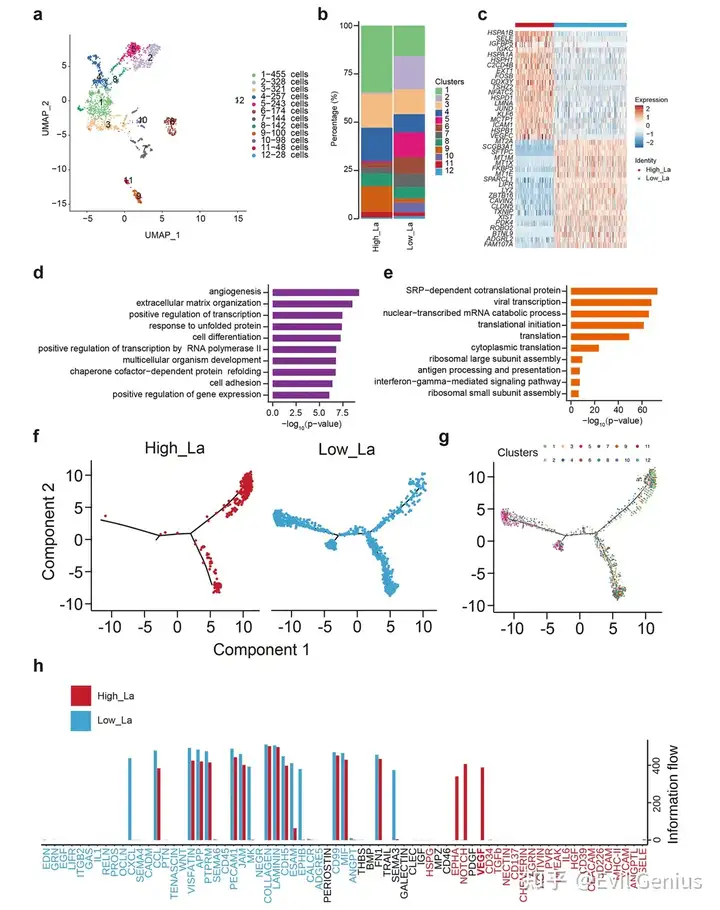
结果6、空间转录组图谱揭示富乳酸肺腺癌组织的细胞类型特异性应答
空间转录组研究结果表明,肺腺癌中升高的乳酸水平通过调控多种细胞类型的分布、转录程序及功能状态,重塑了肿瘤生态系统,从而可能促进肿瘤进展、免疫逃逸及治疗抵抗。
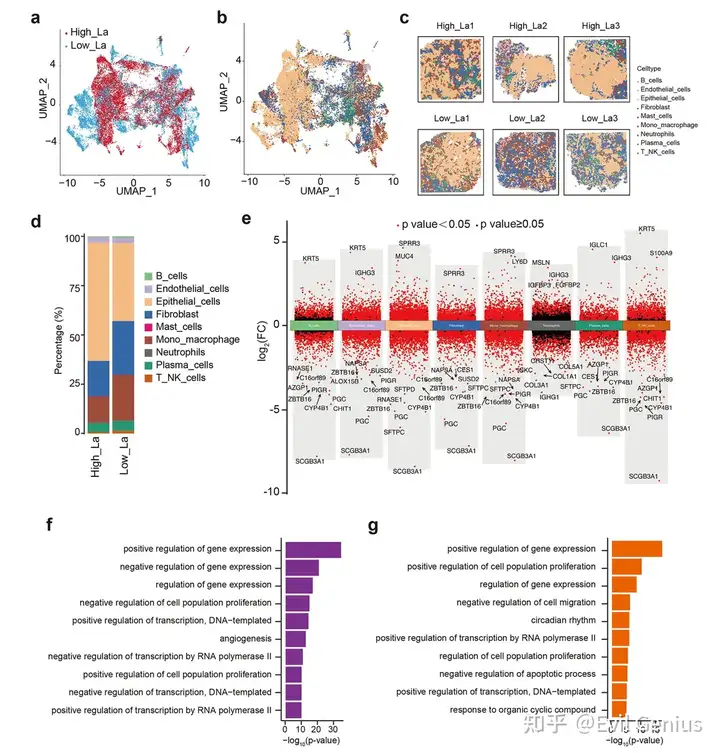
结果7、空间多组学整合揭示肺腺癌中乳酸相关的代谢动态
乳酸作为Warburg effect的关键代谢产物,在实体瘤中常呈高水平状态,并参与免疫抑制、血管生成及肿瘤进展。
乳酸分布与代谢异质性
高乳酸组肿瘤组织中乳酸空间丰度显著升高,且不同细胞类型呈现特异性代谢响应。单核/巨噬细胞、上皮细胞等在高乳酸环境中糖酵解活性增强,内皮细胞却独保持低乳酸表型,提示其通过代谢适应性维持血管稳态。
丙酮酸-乳酸通路的细胞类型特异性调控
低乳酸组整体丙酮酸水平较高,反映氧化代谢倾向;而高乳酸组中,成纤维细胞丙酮酸积累,上皮与免疫细胞则呈耗竭状态,揭示了不同细胞在乳酸压力下代谢分流策略的差异。
内皮细胞的代谢重塑特征
高乳酸微环境诱导内皮细胞代谢重编程:自噬相关通路(如10-乙酰基女贞苷)显著激活,胆碱代谢与神经血管通讯相关通路则受抑制,提示其通过增强自我降解与膜脂重构适应代谢应激。
空间代谢与功能表型的关联
乳酸梯度驱动了细胞的空间分布异质性:低乳酸区域肥大细胞代谢解偶联,高乳酸区域则形成促血管生成与免疫抑制的代谢微环境,共同支持肿瘤进展。
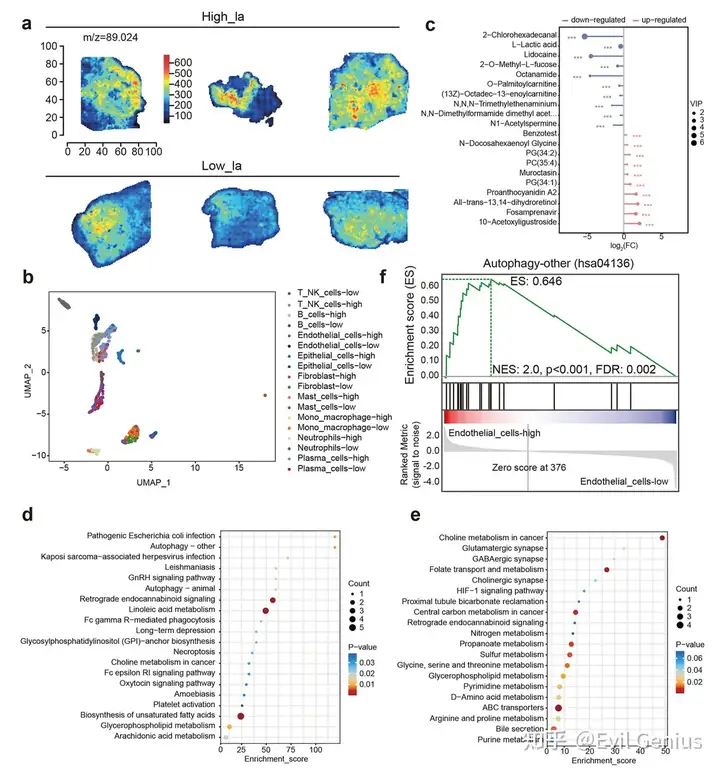
结果8、肺腺癌内皮细胞亚群的预后意义及乳酸高区域的空间重构特征
内皮细胞亚群的临床预后价值
通过整合单细胞测序与TCGA数据,研究发现内皮细胞亚群1和亚群9与肺腺癌患者不良预后显著相关。其中:
亚群1 高表达细胞黏附与血管生成相关基因,下调氧化还原与脂代谢通路,呈现促血管生成表型;
亚群9 激活未折叠蛋白反应与热应激通路,同时抑制翻译起始与抗原呈递功能,体现代谢压力下的应激适应状态。
多重免疫荧光染色进一步证实,高乳酸样本中内皮细胞(标记物FN1)及血管结构(ENG/MMP2)显著增多,提示乳酸积累驱动促血管生成内皮亚群扩增,进而促进肿瘤进展与不良预后。
高乳酸区域的空间多组学重构特征
空间代谢-转录组整合分析揭示,高乳酸区域呈现多细胞协同的代谢与通路重编程:
代谢重编程:上皮细胞、内皮细胞、成纤维细胞及髓系细胞中均出现血管生成与免疫检查点通路富集;多重细胞区室中糖酵解评分升高,氧化磷酸化/缺氧应答特征减弱。
空间组织模式:乳酸强度、免疫耗竭评分与内皮激活评分呈现显著空间自相关性;内皮细胞中免疫耗竭标志物表达同步升高,形成血管生成增强、代谢重塑与局部免疫抑制的空间结构化微环境。
乳酸富集微环境中的免疫-血管交互重塑
SCENIC分析发现,高乳酸肿瘤的内皮与单核/巨噬亚群中,炎症与应激相关转录因子(如RUNX3、NFKB1、XBP1等)调控活性显著升高。配体-受体互作分析显示,APP–CD74、PECAM1–PECAM1等互作在高乳酸环境下显著增强。同时:
巨噬细胞极化:呈现M1样与M2样特征的共富集,体现复杂的表型重编程而非简单极化;
内皮细胞轨迹:高乳酸区域内皮细胞更倾向向促血管生成谱系分化;
空间邻近性:免疫细胞-内皮细胞的空间关系在高乳酸组织中发生重构。
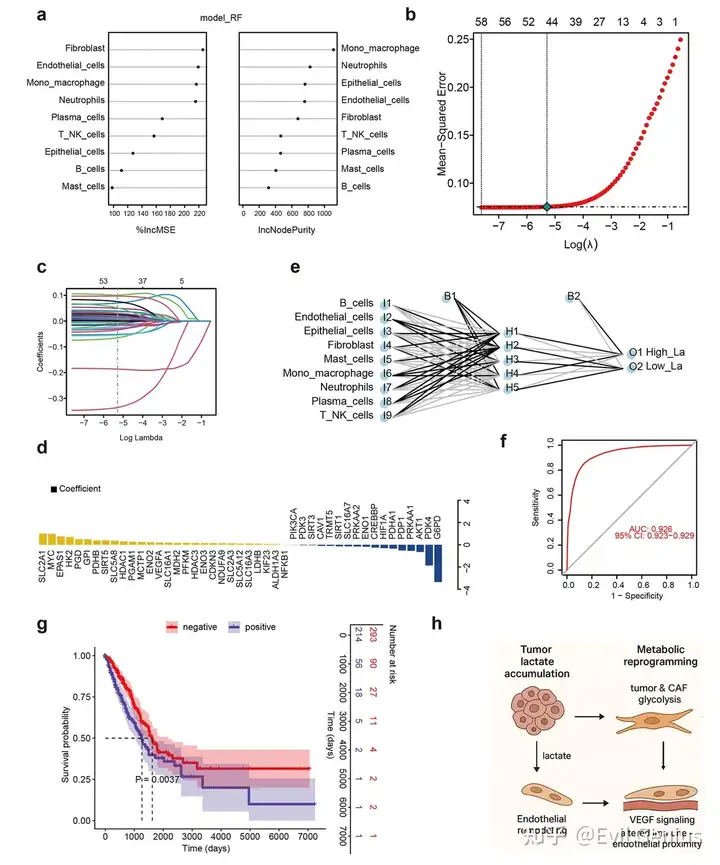
结果9、机器学习模型揭示基质-内皮细胞对乳酸富集状态的决定作用及其预后关联
随机森林分类器在区分高/低乳酸肿瘤时,将成纤维细胞与内皮细胞列为最重要的特征贡献者,印证了二者在塑造富乳酸微环境中的主导作用。弹性网络回归模型通过关联代谢物强度与基因模块评分,实现了0.98的AUC值,并在lambda.1se条件下筛选出一组稀疏的乳酸相关模块。支持向量机分类器进一步识别出包括PDHB、HK2、EPAS1、MYC、SLC21在内的关键判别基因。
基于解卷积空间转录组数据训练的浅层人工神经网络模型达到0.926的AUC值,其可解释的细胞类型权重与随机森林特征排序高度一致。多项逻辑回归分析显示上皮细胞与成纤维细胞是高乳酸状态的重要高风险贡献因子。为评估临床相关性,构建的乳酸相关转录评分可显著分层TCGA-LUAD患者的总生存期。将内皮细胞亚群特征纳入弹性网络Cox模型后,进一步得到显著的风险比,强化了其预后关联。基于乳酸相关基因表达的决策树模型构建了可解释的预后分类器,通过基因表达阈值区分高危与低危患者。TCGA投影分析在独立大样本队列中验证了关键乳酸相关模块(包括糖酵解、内皮活化及免疫抑制模块)的保守性。
综上所述,这些机器学习模型共同揭示:内皮细胞与基质细胞是乳酸富集状态的核心决定因素,其转录特征具有明确的临床预后价值,为针对乳酸微环境的精准治疗策略提供了理论依据。
最后来看看方法


关于作息,你可以试试每天提前半小时睡觉,白天定个闹钟哪怕起来活动10分钟,慢慢调整时差,我之前倒作息就是这么做的,一周左右就好多啦!至于专业也别后悔,食品科学和自动化完全能交叉,比如用机器学习优化食品生产,现在交叉学科很吃香,把两者结合起来反而有独特优势呢~